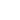2.2.7.1 Природа адгезии
В Введении обсуждаются два случая взаимодействия кантелевера и образца в области действия молекулярных сил: ван-дер-ваальсовское притяжение при отсутствии контакта и упругое взаимодействие при соприкосновении. В промежуточной области, когда между одними парами молекул зонда и образца действуют силы притяжения (потенциал
 ), а между другими – отталкивания
), а между другими – отталкивания
 ), точное нахождение силы взаимодействия всего зонда с образцом невозможно.
), точное нахождение силы взаимодействия всего зонда с образцом невозможно.
Более того, в переходной области возникает качественно новое явление – адгезия. Своим происхождением оно обязано наличию короткодействующих молекулярных сил. Характер адгезии влияет на "склейку" участков графика. Функцию склейки называют адгезионным взаимодействием.
Следует различать две разновидности адгезии: зонд-жидкая пленка на поверхности и зонд-твердый образец. Если первый случай сводится к капиллярному взаимодействию, которому посвящен раздел 2.2.3 "Капиллярные силы", то причина адгезионных сил между зондом и твердым образцом – молекулярное электростатическое взаимодействие.
Рис. 1. Работа адгезии. Показаны зависимости адгезионных сил при подводе
и отводе зонда от поверхности образца.
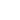
Адгезия – неконсервативный процесс. Силы при подводе кантилевера к образцу отличаются от сил при отрыве зонда от поверхности (рис. 1). На подобную операцию будет потрачена работа, называемая работой адгезии. Распишем эту работу по компонентам [1]:

(1)
Индексы означают:
 – дисперсионное взаимодействие Лондона,
– дисперсионное взаимодействие Лондона,
 – диполь-дипольное (ориентационное) взаимодействие,
– диполь-дипольное (ориентационное) взаимодействие,
 – индукционное взаимодействие,
– индукционное взаимодействие,
 – водородная связь,
– водородная связь,
 –
–
 связь,
связь,
 – донорно-акцепторная связь,
– донорно-акцепторная связь,
 – электростатическое взаимодействие. Причем первые три слагаемых – работа сил Ван-дер-Ваальса.
– электростатическое взаимодействие. Причем первые три слагаемых – работа сил Ван-дер-Ваальса.
Причина адгезии – электростатические силы на границе раздела двух тел, возникающие благодаря образующемуся в контакте двойному заряженному слою. Его происхождение различно для материалов разных типов. Для металлов она определяется контактной разностью потенциалов, состояниями внешних электронов атомов поверхностного слоя и дефектами кристаллической решетки; для полупроводников – поверхностными состояниями и наличием примесных атомов; а для диэлектриков – дипольным моментом групп молекул на границе фаз.
Адгезия – необратимый процесс. При наличии контактной разности потенциалов, например, возникает дрейф электронов, который, как известно, ведет к увеличению энтропии. Именно поэтому силы при сведении и разведении кантилевера и образца различаются, и процесс, тем самым, оказывается неконсервативным.
Для количественного описания адгезии используются приближенные модели. Для твердых тел – это различные поправки к решению задачи Герца.
Выводы.
- Адгезия – прилипание друг к другу находящихся в контакте поверхностей, за счет электростатических сил, природа которых разная для разных материалов.
- Адгезия – неконсервативный процесс, и для разведения поверхностей необходимо затратить дополнительную работу, при этом в месте контакта образуется "шейка".
Литература.
- 3имон А. Д. Адгезия жидкости и смачивание. – М.: Химия, 1974. – 416 с.